Експериментальна перевірка закону Фарадея
| Рівень складності | Середній |  |
| Рівень небезпеки | Безпечно, але під наглядом керівника |  |
| Доступність використовуваних матеріалів | На рівні шкільного обладнання |  |
| Орієнтовний час на виконання роботи | До 1 години |  |
Блок 1. Резюме
Мета роботи: експериментально перевірити закон Фарадея.
Завдання роботи: експериментально визначити кількість металу, що осяде на катоді та розчиниться на аноді під час електролізу, за певного встановленого значення сили струму за певний час та порівняти результат експерименту з теоретичним значенням, отриманим за рівнянням закону Фарадея.
Блок 2. Попередня інформація

Рис. 1. Схема електролізу на прикладі хлориду міді
Електроліз – це розклад речовин (наприклад, води, розчинів кислот, лугів, розчинених або розплавлених солей тощо) постійним електричним струмом.
Електроліз полягає в електрохімічних процесах окиснення та відновлення на електродах. При електролізі позитивно заряджені іони (катіони) рухаються до катода, на якому електрохімічно відновлюються. Негативно заряджені іони (аніони) рухаються до анода, де електрохімічно окислюються.
Хімічні зміни спричинені пропусканням електричного струму крізь розплавлену іонну сполуку або крізь розчин, який містить іони. Їх зумовлює сукупність хімічних реакцій, що протікають під дією електричного струму на електродах, занурених в електроліт; при цьому на катоді відбувається відновлення, а на аноді – окиснення іонів електроліту.
У результаті електролізу на електродах виділяються речовини в кількостях, пропорційних кількості пропущеного струму. Електроліз застосовують для одержання багатьох речовин (металів, водню, хлору та ін.), при гальваностегії (нанесенні металічних покриттів), гальванопластиці (відтворенні форми предметів), а також у хімічному аналізі (полярографія).
На рис. 1 показана схема електролізу на прикладі хлориду міді. При пропусканні електричного струму на катоді буде відновлюватися та осаджуватися мідь, а на катоді буде відновлюватися хлор, окислюючи при цьому метал, з якого зроблений анод. Анод при цьому буде розкладатися в електроліті. Маса катоду буде збільшуватися, а маса аноду – зменшуватися, пропорційно до кількості електрики, що пройшла крізь електролітичну комірку.
Кількісно електроліз описується законом Фарадея, рівняння якого має такий вигляд:
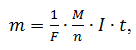 (1)
(1)
де m – маса речовини, осадженої на катоді, г;
F – стала Фарадея, F = 96485,33 Кл/моль;
М – молярна вага речовини, яка осаджується на катоді, г/моль;
n – валентне число іонів речовини (кількість електронів на один іон). Наприклад, для таких металів, як цинк і мідь n = 2.
I – сила струму під час електролізу, А;
t – час електролізу, с.
Якщо в електролітичній комірці за рис. 1 анод буде зроблений з міді, то під час електролізу кількість міді, яка буде осаджуватися на катоді, дорівнюватиме кількості міді, що розчиниться з аноду. Якщо анод буде зроблений з іншого металу, наприклад, цинку, а як електроліт буде використовуватися сіль цього металу, то на катоді осаджуватиметься саме цей метал з такою самою закономірністю.
У реальних умовах під час проведення електролізу, наприклад, при гальванічному нанесенні металів, кількість металу, яка виділиться на катоді, не завжди буде чітко визначатися законом Фарадея. Це відбувається через неідеальність чистоти поверхні катоду, додаткове виділення інших речовин (водню та кисню, які містяться у воді) тощо.
Досліджувана проблема – перевірка закону Фарадея за процесами на катоді та аноді.
Ключові терміни та поняття, які дають змогу засвоїти процес виконання роботи: електроліз, електроліт, закон Фарадея.
Джерела інформації, які попередньо потрібно опрацювати:
Блок 3. Обладнання
хлорид або сульфат міді, відрізки листової міді, хімічна склянка, електронні терези, секундомір, регульоване джерело живлення з індикацією напруги та струму, з’єднувальні провідники.
Основні терміни та поняття
ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ – СТРУМ В ЕЛЕКТРОЛІТАХ Електропровідність електролітів. Закони Фарадея ЗАКОН ЕЛЕКТРОЛІЗУ. ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ – СТРУМ В ЕЛЕКТРОЛІТАХ
Блок 4. Експериментальна процедура
- Виріжте з листової міді дві приблизно однакові смужки та зачистіть їх за допомогою шліфувальної шкурки або ножа.
- Оберіть, яка з них буде анодом, а яка – катодом та нанесіть на них відповідні помітки за допомогою голки або цвяха.
- За допомогою електронних терезів визначте первинну вагу катоду та аноду – mк1 та mа1 та занесіть ці значення до таблиці результатів.
- Приготуйте розчин сульфату або хлориду міді з концентрацією 20-25 % у хімічній склянці.
- Установіть анод і катод у хімічну склянку так, щоб вони не дотикалися.
- Підключіть джерело живлення до отриманої комірки: «мінус» – на катод, «плюс» – на анод.
- Увімкніть джерело живлення, встановіть певне значення сили струму у межах 0,1-0,2 А та увімкніть секундомір.
- Зачекайте 10-30 хв. У процесі експерименту підтримуйте стале значення сили струму за допомогою регуляторів джерела живлення.
- Вимкніть джерело живлення, витягніть та промийте електроди.
- Після підсихання знову визначте масу катоду та аноду – mк2 та mа2.
Блок 5. Аналіз отриманих даних
- Результати досліджень запишіть у таблицю:
| І, А | t, с | mк1, г | mа1, г | mк2, г | mа2, | Δmк, г | Δmа, г | m, г |
- Визначте масу міді, осадженої на катоді, та масу міді, розчиненої з анода, за формулами:
![]() . (2)
. (2)
- За рівнянням закону Фарадея (1) визначте теоретичну кількість міді.
- Порівняйте теоретичну масу міді з масою міді, осадженої на катоді, та масою міді, розчиненої з аноду, за результатами експерименту.
- Дійдіть висновків щодо відтворення закону Фарадея за обома електродами.
Блок 6. Напрями розвитку
- Теоретично та експериментально визначте товщину шару металу, що осаджується на катоді в процесі електролізу.
- Запропонуйте варіанти практичного застосування явища, що було досліджене.